7/26/2012
The Threat of the Brown Marmorated Stink Bug
Stanton Gill, Karen Rane, Suzanne Klick & David Clement
 Editor’s note: Dr. Gill and his team first reported on the brown marmorated stink bug in the December 2010 issue of GrowerTalks. This article is a follow-up that includes two more years of research.
Editor’s note: Dr. Gill and his team first reported on the brown marmorated stink bug in the December 2010 issue of GrowerTalks. This article is a follow-up that includes two more years of research.
If you haven’t heard of
the brown marmorated stink bug (BMSB), don’t worry—you probably will in
the very near future. This bug was introduced from Asia and has hitchhiked across
the United States and into Canada. Officials in Mexico are anticipating that it will visit
them soon. It’s even managed to hitch an airplane ride to Switzerland.
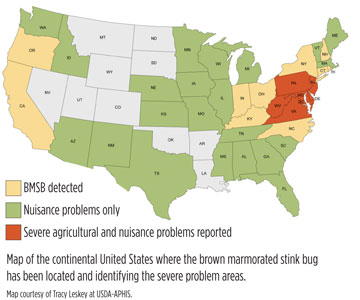
This pest has potential to spread through Central America and most of Europe. Six states are currently listed as
the epicenter of this outbreak, including Maryland, Pennsylvania, West Virginia, Virginia, New Jersey and Delaware. USDA-ARS is leading a team approach to dealing with this invasive, fast-spreading pest. Being in one of
the “epi-center” states encouraged us to investigate
the potential damage from this invasive pest before it becomes well established in o
ther locations. (See map.)
 Purpose & methods
Purpose & methods
Is
the brown marmorated stink bug a major threat to greenhouse bedding plants, vegetable transplants and herbaceous
perennial plants? That is what we hoped to answer when we began our study at
the University of Maryland Central Maryland Research and Education Center.
We started by contacting Steven Still at
the Perennial Plant Growers Association for a list of key herbaceous
perennials that were legumes. In
the published literature, this Asian pest was listed as feeding on plants in
the legume family. In Maryland,
they had been observed damaging legume crops such as soybeans. Steven Still reported
the following legumes were grown by
perennial growers: baptisia, lupinus,
Thermopsis caroliniana,
Galega hartlandii,
Lathyrus latifolius and indigofera. We
then went to four major herbaceous
perennial growers in Maryland to see which of
these legume family
perennials
they commonly grew for market. We decided since lupines were
the most commonly used, we would include this
perennial in
the trial.
We also surveyed to see if
they had detected BMSB feeding on any herbaceous
perennials in
their nurseries.
BMSB had been observed feeding and laying eggs on tomatoes and peppers in commercial production fields and homeowners’ gardens. Since greenhouse growers grow tomatoes and pepper transplants, we added
these to
the list of greenhouse crops to evaluate
the impact of BMSB.
The rest of
the list of herbaceous annual plants (basically bedding plants) were selected based on information from growers or Master Gardeners who had observed BMSB feeding on
these plants in
the landscape.
The list of plants involved in
the trials includes: tomato, pepper, garden impatiens, petunia, New Guinea impatiens, celosia, snapdragon, dahlia, baptisia, lupine and heuchera.
We worked with two commercial greenhouses and one herbaceous
perennial growing operation to obtain plants for our replicated trials. Plants were moved into
the University of Maryland Greenhouse in
the first week of April 2011 and arranged in three randomized blocks. A second set of three blocks was established in
the first week of May. Each block was made up of a mosquito net tent placed on
the greenhouse bench containing 8 plants of each species. A total of 78 plants were placed in each tent. Plant species were randomized in
the 6 tents.
The tented areas were each 36 in. wide, 72 in. long and 48 in. high.
The mosquito net tent confined
the BMSB to
the test plants and did not allow
them to escape into
the greenhouse.
Adult BMSB used in this study were obtained from a colony maintained at
the University of Maryland CMREC lab.
The BMSB were sexed (male and females divided out) at our lab with 50 males and 50 females being selected for release in each tent. Initially, we thought one release would be sufficient, but due to high mortality after 7 days, we made weekly releases of BMSB adults to keep
the population at our target of 100 per tent.
Each week we evaluated
the plants for leaf and flower injury and observed feeding activity of BMSB. We also checked
the plants to see if egg laying occurred on
the plants. Plants were also examined for
the presence of disease symptoms, in case feeding damage predisposed plants to disease.
No insecticides were used in
the test area. To deal with thrips and aphids, we used biological control measures. For thrips control we released
Amblyseius cucumeri at 5 per sq. ft. of growing area, releasing one time in each netted area. For aphid control, we released
Aphidius colemani and
Aphidius ervi at a rate of 2 per sq. ft. of growing area.
The trials started in
the first week of April and continued until late June with observations being made on a weekly basis.
What we found
Baptisia had heavy feeding activity by April 19 on stems and foliage. Even though
the feeding was heavy with as many as 7 BMSB recorded feeding on one plant at one time, no visible damage was recorded on this plant. Heuchera appears to be of no interest to BMSB with no feeding or injury to foliage occurring on this plant. Dahlia foliage and stems were fed on by BMSB, but no measureable damage was found on
the plants from
the feeding. We observed heavy feeding on foliage of petunias causing a stippling damage with chlorophyll breakdown. No damage was found on
the flowers.
BMSB also fed heavily on snapdragon plants, seeming to prefer
the seedpods that formed after flowering. Again, no damage was found on
the flowers. BMSB did not feed or lay eggs on celosia in
the trial blocks. BMSB fed on tomato and pepper stems, flowers and fruit, causing stippling of foliage and spotting of fruit. No egg laying occurred on any plants in this study, and we found no disease symptoms associated with BMSB feeding injury.
In addition to
the trial at
the University of Maryland greenhouse, we placed pheromone traps at 4 commercial greenhouse operations. One trap was placed outside and one inside a greenhouse at each of
the locations. We also worked with four roll-up side high-tunnel operations in monitoring for BMSB activity. Traps were placed inside and outside of
the high tunnels and whole plant counts were conducted similar to
the method used in
the greenhouse survey. We counted insects in
the traps weekly from late July through
the end of October and conducted 15-minute plant examinations at each of
the operations. At
the commercial greenhouse sites, we consistently found nymphs and adults in
the traps outside
the greenhouse and on surrounding plants throughout
the monitoring time. We found no adults, nymphs or eggs on plants inside
the commercial greenhouses during our monitoring period. In
the high tunnel operations, we found nymphs on plants near
the baited trap in mid-August and a few adults in early September, but this was significantly less than
the number of BMSB on plants or traps outside of
the greenhouse.
Conclusion
When we confined BMSB on plants in a greenhouse,
they fed on herbaceous transplants such as snapdragon, petunia, dahlia, baptisia, pepper and tomato. BMSB did not survive well in
the greenhouse environment. In our survey of commercial greenhouses, BMSB was found in headhouses, in sheds and barns, but were not found in greenhouse growing structures and none were found feeding on any of
the plant material. We suspect that one or more factors in
the greenhouse environment are not conductive to BMSB. This is good news for greenhouse growers.
GT
Funding for this study was provided by the Maryland Nursery and Greenhouse Association.
Stanton Gill is Extension Specialist in IPM and Entomology for the University of Maryland extension and CMREC and Professor for Montgomery College, Landscape Technology Program. He can be reached at Sgill@umd.edu. Karen Rane is Extension Specialist in Plant Pathology and Director of the University of Maryland Plant Diagnostic Clinic for the University of Maryland Extension. She can be reached at Rane@umd.edu. Suzanne Klick is Lead Technician for the University of Maryland Extension, CMREC. She can be reached at Sklick@umd.edu. David Clement is Extension Specialist in Plant Pathology for the University of Maryland Extension, HGIC. He can be reached at Clement@umd.edu.
Nota del editor: El Dr. Gill y su equipo reportaron el chinche apestoso por primera vez en la edición de Diciembre de 2010 de GrowerTalks. Este artículo es un seguimiento a los primeros hallazgos, e incluye dos años más de investigación.
Si Ud. no ha escuchado hablar del chinche apestoso marmolado pardo (BMSB por sus siglas en inglés) no se preocupe—probablemente lo hará en el futuro cercano. Este chinche fue introducido desde el Asia y se ha abierto camino desde los Estados Unidos hasta Canadá. Las autoridades Mexicanas esperan que los visite pronto, e incluso ha logrado viajar como polizón dentro de un avión que se dirigía a Suiza.
La plaga tiene potencial para diseminarse a través de América Central y gran parte de Europa. Seis estados aparecen actualmente en la lista que conforma el epicentro de este brote, incluyendo Maryland, Pensilvania, Virginia Oeste, Virginia, Nueva Jersey y Delaware. El USDA-ARS lidera un equipo para manejar esta especie invasiva y de rápida dispersión. El hecho de estar en uno de los estados “epicéntricos” nos animó a investigar el daño potencial que representa esta plaga invasora antes de que se establezca en otras localidades. (Ver mapa.)
Propósito & métodos
¿Es el chinche apestoso una gran amenaza para las plantas de surco, plántulas de hortalizas y plantas perennes herbáceas cultivadas bajo invernadero? Esto fue lo que quisimos responder cuando iniciamos nuestro estudio en el Centro de Investigación y Educación de Maryland Central, de la Universidad de Maryland.
Comenzamos por contactar a Steven Still en la Asociación de Productores de Plantas Perennes, pidiéndole una lista de plantas perennes herbáceas que son leguminosas, pues la literatura reporta esta plaga Asiática alimentándose de plantas de esa familia y en Maryland se habían observado causando daños en cultivos leguminosos como la soya. Steven Still reportó las siguientes leguminosas perennes en producción: baptisia, lupinos,
Thermopsis caroliniana,
Galega hartlandii,
Lathyrus latifolius e indigofera. Luego visitamos cuatro productores grandes de perennes herbáceas en Maryland, para ver cuáles de estas plantas cultivaban comúnmente, y decidimos incluir los lupinos en nuestros ensayos, al ver que eran muy comunes.
También condujimos una encuesta para ver si habían observado el BMSB alimentándose de alguna planta perenne dentro de sus viveros.
El BMSB había sido observado alimentándose y poniendo huevos en campos de tomates y pimientos, y en jardines particulares. Puesto que las plántulas de tomate y pimiento se producen bajo invernadero, agregamos estos a la lista de especies a ser evaluadas. El resto de la lista de plantas herbáceas anuales (básicamente plantas de surco) fue seleccionado con base en información suministrada por productores o Jardineros Maestros que habían observado el BMSB alimentándose de estas plantas.
La lista de plantas incluidas en el ensayo comprende: tomate, pimiento, impatiens de jardín, petunias, impatiens Nueva Guinea, celosia, bocas de dragón, dalia, baptisia, lupino y heuchera.
Trabajamos con dos invernaderos comerciales y un cultivo de perennes herbáceas, que nos suministraron plantas para los ensayos y sus réplicas. Las plantas fueron transferidas a los invernaderos de la Universidad de Maryland durante la primera semana de Abril de 2011 y organizadas en tres bloques aleatorios; un mes más tarde, en la primera semana de Mayo, se estableció un segundo grupo de tres bloques. Cada bloque constaba de una carpa fabricada con malla para mosquitos colocada sobre un banco de invernadero que contenía 8 plantas de cada especie, para un total de 78 plantas bajo cada carpa. Las especies de plantas fueron colocadas aleatoriamente bajo 6 carpas de 36 in. de ancho por 72 in. de largo y 48 in. de alto. La malla confinaba el BMSB a las plantas del ensayo, sin dejarlo escaparse al resto del invernadero.
Los BMSB adultos utilizados en el estudio fueron obtenidos de una colonia mantenida en el laboratorio CMREC de la Universidad de Maryland. Los chinches fueron sexados en nuestro laboratorio (separados machos de hembras), seleccionando 50 machos y 50 hembras para ser liberados dentro de cada carpa. Inicialmente pensamos que una liberación sería suficiente, pero debido a la alta mortalidad registrada después de 7 días, decidimos hacer liberaciones semanales de adultos para mantener la población dentro de nuestra meta del 100 por carpa.
Cada semana evaluamos las plantas en busca de daños en las hojas y flores y observar la actividad alimenticia de los chinches. También revisamos las plantas para ver si había ocurrido oviposición y en busca de síntomas de enfermedad, en caso de que el daño causado por la alimentación de los chinches predispusiera las plantas a enfermedades.
No se usaron insecticidas en el area de ensayo. Para controlar thrips y áfidos usamos medidas de control biológico: para el control de thrips liberamos Amblyseius cucumeri a razón de 5 por ft2 de área de cultivo, y una vez en cada área enmallada. Para el control de áfidos liberamos
Aphidius colemani y
Aphidius ervi en dosis de 2 por ft2 de área de cultivo. Los ensayos comenzaron la primera semana de Abril y continuaron hasta fines de Junio, con observaciones semanales.
Lo que encontramos
El 19 de Abril, la baptisia ya mostraba una intensa actividad de alimentación en tallos y follaje, pero aún cuando llegaron a reportarse hasta siete chinches sobre una misma planta a la vez, no se registraron daños visibles sobre las mismas. La heuchera no parece interesar al BMSB y no se observe daño alguno en el follaje de estas plantas. El BMSB se alimentó del follaje de las dalias, pero no se encontraron daños medibles causados por esta actividad en las mismas. Observamos intense actividad en las hojas de petunia, que causó un moteado con descomposición de clorofila, pero ningún daño en las flores.
El chinche también se alimentó profusamente de las plantas de boca de dragón, pareciendo preferir las cápsulas de semillas que se forman después de la florescencia; nuevamente, no se encontraron daños en las flores. El BMSB no se alimentó o puso huevos en las plantas de celosia que se encontraban en los bloques del ensayo, sin embargo, sí se alimentó de los tallos, frutos y hojas de los tomates y pimentones, causando moteados en el follaje y manchas sobre los frutos. No se observó oviposición sobre ninguna de las plantas incluidas en este estudio, ni se encontraron síntomas de enfermedad asociados a los daños causados por el chinche.
Además de los ensayos realizados en los invernaderos de la Universidad de Maryland, colocamos trampas de feromonas en 4 invernaderos comerciales, una al exterior y una dentro de cada invernadero, en cada una de las localidades. También trabajamos en cuatro instalaciones tipo túnel alto con cortinas laterales enrollables, monitoreando la actividad del BMSB. Colocamos trampas dentro y fuera de los túneles, y realizamos conteos sobre plantas completas, de manera similar a la utilizada en la encuesta de los invernaderos. Contamos semanalmente el número de insectos, entre el fin de Julio y el fin de Octubre, realizando exámenes a las plantas durante 15-minutos en cada localidad. En los invernaderos encontramos consistentemente ninfas y adultos en las trampas al exterior de los invernaderos y el las plantas circundantes. No encontramos adultos, ninfas o huevos en plantas dentro de los invernaderos durante el período de monitoreo. En los túneles altos encontramos ninfas sobre las plantas que se encontraban cerca de la trampa a mediados de Agosto y comienzos de Septiembre, pero su número fue significativamente menor que el número de chinches presentes sobre las plantas o sobre las trampas al exterior de los invernaderos.
Conclusión
Cuando confinamos los BMSB a las plantas del invernadero, éstos se alimentaron de plántulas herbáceas tales como bocas de dragón, petunias, dalias, baptisias, pimientos y tomates, sin embargo el BMSB no sobrevivió bien en el ambiente del invernadero. En la encuesta que realizamos entre los invernaderos comerciales, encontramos BMSB en instalaciones principales, alacenas y establos, pero no en los invernaderos o estructuras de cultivo y no se encontró ninguno alimentándose del material vegetal. Sospechamos que uno o más factores del ambiente del invernadero no son favorables al BMSB, lo cual es una Buena noticia para los productores.
GT
La financiación para este studio fue proporcionada por la Asociación de Viveros e Invernaderos de Maryland.
Stanton Gill es Especialista en Extensión para MIPy Entomología de la Universidad de Maryland y el CMREC y Profesor del Montgomery College, Programa de Tecnologìa del Paisaje. Puede ser contactado en Sgill@umd.edu. Karen Rane es Especialista en Extensión en Fitopatología y Directora de la Clínica de Diagnóstico Vegetal de la Universidad de Maryland. Puede ser contactada en Rane@umd.edu. Suzanne Klick es Técnica Líder Lead del servicio de Extensión de la Universidad de Maryland, CMREC. Puede contactarse en Sklick@umd.edu. David Clement es Especialista en Extensión en Fitopatología del servicio de Extensión de la Universidad de Maryland, HGIC. Puede contactarse en Clement@umd.edu.